Breve historia del proceso.
Evolución del proceso de desintegración catalítica.
La desintegración catalítica conocida desde principios del siglo, se aplicó industrialmente en el año 1936, con un proceso de lecho fijo desarrollado por Eugene Houdry de la Compañía Socony Oil. El proceso era cíclico, con tiempos de 10 minutos para la reacción, 10 minutos para el cambio de reactor y válvulas, y de 10-20 minutos para el quemado de carbón. El calor de combustión era transferido al sistema reaccionante mediante un dispositivo de transferencia de calor a base de sal fundida.
El proceso Houdry, conocido así en honor a su inventor, evolucionó rápidamente y se transformó en el proceso de lecho móvil TCC (Thermofor Catalytic Cracking). En 1940 se tenían, ya algunas unidades industriales de desintegración catalítica TCC. Los diseñadores rápidamente comprendieron las ventajas de este nuevo proceso, ya que eliminó algunos de los inconvenientes del proceso de lecho fijo, tales como el intercambio de calor y la flexibilidad de la operación, y lo impulsaron de tal modo que su evolución ha sido una de las más espectaculares de la industria petrolera.
En 1943 inició operaciones en Baton Rouge, Lousiana, EUA, la primera unidad de desintegración catalítica de lecho fluidizado en flujo ascendente, por parte de la Compañía Standard Oil. Las ventajas de este proceso fueron evidentes, y rápidamente las diversas firmas de ingeniería aceleraron su evolución. En 1944 aparece la unidad de flujo descendente de la Compañía Standard Oil Development, con la cual se simplificaba la recuperación de catalizador y la distribución de las instalaciones.
Para 1947 se introduce el modelo de presiones equilibradas diseñado por la Compañía Kellogg. En este modelo los reactores estaban localizados lado a lado y a la misma altura, reduciendo el tamaño de la unidad y con las ventajas de facilidad de mantenimiento, menor costo inicial, operación a baja presión con la consecuente producción de gasolina de mayor calidad, menor producción de coque y menor pérdida de actividad catalítica.
La unidad de la Compañía ESSO se inició comercialmente en 1951 y sus ventajas principales heron la reducción del tamaño de la unidad, sin reducir la capacidad, y el empleo de líneas de transferencia de diseño especial que minimizaban la corrosión.
Otras compañías continuaban estudiando y desarrollando sus propias concepciones. Así, la UOP (Universal Oil Products) puso en operación en 1947 la primera unidad con el reactor y regenerador superpuestos, con las ventajas resultantes como son la eliminación de líneas de transferencia, reactor más pequeño y menor costo de construcción. La Compañía Kellogg en 1951 pone en marcha la primera unidad Orthoflow, que elimina las líneas externas para el catalizador, utilizando tuberías rectas para la circulación de catalizador.
Con la introducción de los catalizadores zeolíticos en la década de los sesentas, cuya actividad es mucho mayor a la de los catalizadores de sílice-alúmina amorfos, se planteó la necesidad de reducir el tiempo de contacto entre el catalizador y el aceite, a fin de disminuir la sobredesintegración y hacer más eficiente la operación. La respuesta a esta necesidad fue la unidad de reacción en el tubo elevador o “riser”, con lo cual la flexibilidad en el control de la reacción es mayor, pudiendo de esta manera, aumentar la eficiencia y aprovechar esa importante característica.
El proceso Ultra Orthoflow de la Compañía Kellogg permite aprovechar en forma eficiente la elevada actividad de los catalizadores zeolíticos, lo cual se logra incorporando un sistema con varias etapas para el agotamiento de hidrocarburos en el catalizador, además del uso de ciclones que permiten una mejor separación hidrocarburo-catalizador y mayor eficiencia en la recuperación de este último. En la actualidad la mayoría de las unidades de desintegración catalítica FCC efectúan las reacciones de desintegración en el tubo elevador.
La desintegración catalítica en México.
La desintegración catalítica FCC inició en México en el año de 1958 con la adquisición de una unidad modelo IV de la compañía ESSO de 25,000 BPD para la ex-Refinería de Azcapotzalco (Figura 1.3), la cual al cierre de esta refinería en 1993, fue trasladada a la Refinería de Cadereyta y rediseñada por la compañía Stone & Webster (S&W).
Dos años después, en 1960, se adquirió otra unidad modelo ESSO-IV de mayor capacidad (43,000 BPD) para la Refinería de Cd. Madero, la cual fue rediseñada en 1972 para incrementar su capacidad a 51,000 BPD. En la Refinería de Minatitlán en 1963, se optó por la adquisición de una unidad modelo UOP (Figura 1.4) con capacidad de 24,000 BPD.
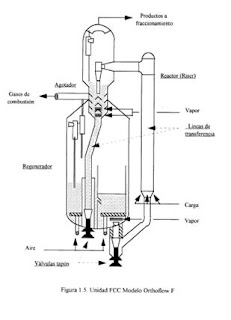
A partir de 1972 se inició la adquisición de Unidades FCC Modelo Orthoflow (Figura 1.5) y desde 1988 el Modelo Ultra Orthoflow, ambos diseños de la compañía Kellogg. Una de las diferencias principales entre estas unidades es que el modelo Orthoflow opera a combustión parcial y el modelo Ultra Orthoflow a combustión completa.
En la Tabla 1.4 se muestra en forma cronológica la evolución que han tenido las unidades FCC en México (Mariaca, 1996).
Catalizadores de FCC utilizados en las refinerías mexicanas.
Los catalizadores de FCC que actualmente se emplean en las Refinerías en México son en su mayoría formulados por el Instituto Mexicano del Petróleo y representó en 1997 el 80% del consumo total anual.
Aspectos termodinámicos.
En algunos sistemas reaccionantes, los datos termodinámicos son extremadamente valiosos para predecir el posible avance de la reacción y las condiciones de reacción más adecuadas.
En el caso de la desintegración catalítica, las reacciones principales no están limitadas por el equilibrio termodinámico bajo las condiciones de operación industriales, de hecho, el equilibrio de ciertas reacciones de desintegración de hidrocarburos resulta en la degradación casi completa a carbono e hidrógeno, ya que todos los hidrocarburos, excepto el metano, tienen un cambio favorable en la energía libre a temperaturas superiores a 400°F (204 °C), como se muestra en la Tabla 1.6.
Las reacciones laterales, tales como isomerización, arreglo del grupo alquilo y desalquilación de aromáticos, ocurren sólo en forma moderada a las condiciones de desintegración.
Otras reacciones, como la alquilación de parafinas-olefinas, hidrogenación de aromáticos y polimerización de olefinas (excepto la polimerización de etileno) no son factibles de efectuarse en las unidades FCC a las condiciones de operación normales.
Las reacciones de desintegración son endotérmicas, las de isomerización tienen calores de reacción muy bajos y las reacciones de transferencia de hidrógeno son exotérmicas. Las reacciones endotérmicas siempre predominan en el proceso de desintegración. El balance térmico depende del tipo de carga, del catalizador y de las condiciones de operación.
Estudio de la planta de Cadereyta FCC-II
Descripción del Proceso
La planta Hidrodesulfuración de Naftas N°2 de Cadereyta, N. L., se diseñó para procesar 25,000 BPD de una corriente proveniente de almacenamiento, constituida por una mezcla de Naftas que se producen en las plantas Hidrotratadora de Diesel, Hidrotratadora de Gasóleos, Coquizadora, Reductora de Viscosidad y Plantas Combinadas 1 y 2.
De acuerdo con el tipo de alimentación a procesar, será diferente el arreglo o la distribución de los equipos que interviene en el proceso.
Básicamente el proceso consiste en la hidrogenación catalítica de los compuestos de azufre, nitrógeno, olefínicos, entre otros presentes en las diversas alimentaciones, para lo cual se emplea una corriente rica en hidrógeno. Para facilitar la descripción del proceso de la planta de hidrodesulfuración de Naftas N°2 de Cadereyta N. L., se pueden establecer tres secciones principales del proceso que son:
o Sección de Reacción.
o Sección de Fraccionamiento.
o Sección de Endulzamiento con Amina.
Sólo se discutirá la sección de reacción:
Sección de reacción (Diagrama de Flujo de Proceso)
La función principal de la sección es la hidrogenación catalítica de los compuestos de azufre, nitrógeno y olefinas presentes en la carga a la planta de la siguiente forma:
La corriente de alimentación constituida por la mezcla de naftas que proviene de almacenamiento se recibe en L.B. a 4.5 Kg/cm2 manométricas y 38°C, pasa a través del filtro de carga FG-401 A/B y se introduce a control de nivel al tanque de carga, FA-401, el cual opera a 3.0 Kg/cm2 manoy 38°C. En caso de tenerse un excedente de nafta, este se retorna a almacenamiento, existiendo también la posibilidad de recibir cualquier corriente de nafta de almacenamiento en forma directa de la planta que la genera.
El tanque de carga cuenta con una pierna separadora para eliminar el agua amarga que pudiera traer consigo la corriente de alimentación, enviándose está a control de nivel al tanque de agua amarga. Por su parte la nafta se envía mediante la bomba de carga GA-401/R, a control de reflujo al reactor de saturación de diolefinas DC-401, previo precalentamiento en el Intercambiador de carga/nafta pesada producto EA-401 y en el segundo intercambiador carga efluente del reactor EA-402 y previa mezcla con una corriente de hidrógeno de reposición, la cual se introduce mediante una relacionador de flujo. En el DC- 401 se realiza la saturación de las diolefinas mediante una reacción de hidrogenación catalítica en fase líquida a 60.6 Kg/cm2 manométricas y 150°C.
El efluente del reactor, libre de diolefinas, se mezcla con el hidrógeno de recirculación mediante un relacionador de flujo y se precalienta en el primer intercambiador carga/efluente del reactor EA- 404. Posteriormente se introduce al calentador de carga BA-401; en donde se ajusta la temperatura requerida para alimentarse al reactor de hidrodesulfuración DC-402.
Debido a que las reacciones que se producen en el reactor son altamente exotérmicas se alcanzan temperaturas altas que afectan la dirección de las reacciones por lo que es importante regular la temperatura dentro del reactor DC-402, para ello se inyecta en la parte media del reactor una corriente de nafta caliente proveniente del separador caliente de los productos del reactor FA-402, que está a una temperatura de 157°C.
Como consecuencia de lo anterior, el producto del reactor contiene un alto potencial térmico que es aprovechado en el tren de intercambio, precalentando la carga a la torre desbutanizadora en el cambiador de calor EA-405, la corriente de alimentación al reactor de hidrodesulfuraCión en el cambiador de calor EA-404, la corriente al reactor de saturación de diolefinas en el cambiador de calor EA-402 y posteriormente se introduce al separador caliente de los productos del reactor FA-402, a una temperatura de 157° C y a 49.6 Kg/cm2 manométricas. Para ajustar la distribución del calor de la corriente del efluente del rector existen corrientes de desvío a control de temperatura, el ya mencionado en el cambiador de calor EA-402 y en el cambiador de calor EA-405, que regula la temperatura de alimentación a la torre desbutanizadora.
Del tanque FA-402 se obtienen dos corrientes, una en fase vapor, constituida principalmente por hidrógeno e hidrocarburos, a la que se le inyecta agua de lavado junto con un inhibidor de corrosión para prevenir el depósito de cristales de amonio, mediante la bomba de agua de lavado GA-409/R, posteriormente, se enfría y condensa parcialmente en el primer enfriador de nafta del reactor, EC-401 y en el segundo enfriador de nafta del reactor EA-412 y por último se introduce al tanque separador frío de los productos del reactor FA-411, a 48.2 Kg/cm2 manométricas y 43°C.
La otra corriente del separador FA-402, en fase líquida, se divide en dos corrientes, una se recircula a la salida del primer lecho del reactor, a control de flujo en cascada con la temperatura del efluente del reactor o la intermedia del segundo lecho, mediante la bomba de nafta de apagado GA-407/R. La otra se envía a control de nivel del separador FA-402 al primer separador de nafta a la torre desbutanizadora FA-404 de la sección de fraccionamiento.
En el tanque FA-411 se separan tres fases: nafta fría que se envía al EA-410 de la sección de fraccionamiento, agua amarga que se envía al tanque de agua amarga y una corriente de vapor rica en hidrógeno que se envía al compresor de hidrógeno de recirculación GB-402, previo paso por el tanque de succión del compresor de hidrógeno de recirculación FA-403. De esta corriente antes del tanque de succión, se extrae una corriente de purga que se envía a endulzamiento a control de presión.
La planta recibe el hidrógeno de reposición de L.B. a 19.0 Kg/cm2 manométricas y 38°C con una alta pureza (99.5% mol) de la red de hidrógeno. Esta corriente se recibe en el tanque de succión del compresor de hidrógeno de reposición FA- 409, se incrementa su presión en la primera etapa del compresor de hidrógeno de reposición GB-401 NB/C, posteriormente se acondiciona su temperatura con el interenfriador del compresor de hidrógeno de reposición EC-405 NB/C, se introduce al tanque interetapa del compresor de hidrógeno de reposición FA- 410 NB/C y se manda a la segunda etapa del compresor GB-401 NB/C. Para controlar el flujo de hidrógeno de reposición se cuenta con una línea de recirculación de la descarga de la segunda etapa del compresor al tanque de succión de la primera etapa, acondicionando su temperatura con el enfriador de hidrógeno de reposición EC-406.
El hidrógeno comprimido se divide en dos corrientes, una de ellas se envía como carga al reactor de saturación de diolefinas con un relacionador de flujo y la otra se mezcla con la descarga del compresor GB-402 y se retornan al sistema de reacción, antes de pasar por el cambiador EA-404.
Fundamentos Teóricos
La hidrodesulfuración se lleva acabo para la eliminación de compuestos de azufre, presentes en los diferentes flujos de alimentación de una planta, estas alimentaciones pueden ser: nafta ligera, nafta pesada, turbosina y gasóleos, todos estos son producto de la destilación primaria del petróleo. El conocer las especies químicas que contienen los diferentes tipos de alimentación a la planta de hidrodesulfuración, nos ayudara a fijar las condiciones óptimas de operación del proceso y obtener un producto con la calidad y especificaciones requeridas. En la actualidad la tendencia está orientada hacia una obtención de combustibles más limpios, con aproximadamente un 99% de remoción de azufre; por lo cual se hace indispensable el conocimiento de los principales compuestos que intervienen en las reacciones químicas de remoción, saturación, craqueo e hidrogenación de las distintas especies químicas presentes en los diferentes tipos de alimentación a procesar son el fundamento del proceso de hidrodesulfuración, así entonces se pueden mencionar los siguientes aspectos determinantes en el proceso:
· Compuestos de Azufre.
· Compuestos de Nitrógeno.
· Saturación de (mono y di) Olefinas.
· Saturación de Anillos Aromáticos.
· Remoción de Sílice.
· Variables de Control de Proceso (Sección de Reacción).
Para fines de este proyecto únicamente discutiremos las que son importantes para el proceso designado:
· Saturación de mono olefinas
· Saturación de diolefinas
Saturación de mono olefinas
Estudios en planta piloto han demostrado que la presencia en ocasiones de pequeñas cantidades de olefinas puede limitar la desulfurización debido a que la recombinación de olefinas con ácido sulfhídrico (H2S) puede confundir los resultados obtenidos en una simulación de alguna planta en diseño o alguna planta en proceso. Esto es si la presencia de mercaptanos no es anticipada, la cual indica una reacción de recombinación con el H2S como se muestra a continuación:
Reacción de reconversión de las olefinas.
Esta reacción es reversible la cual cambia ala izquierda a alta presión parcial de H2S como característica principal, aunque también esta reacción depende de la temperatura, tipo de alimentación, el azufre total en la alimentación, la presión parcial de hidrógeno, el contenido de olefinas, el espacio velocidad, y la configuración del reactor.
Por lo tanto para obtener un alto nivel de conversión de azufre, Ia presión parcial ejercida por el H2S puede ser un parámetro esencial a cuidar, debido a que en niveles de alta conversión de azufre el flujo neto de desulfurización de la nafta puede estar limitado por las concentraciones en el reactor tanto por las olefinas como de H2S.
Sin embargo, el efecto de la temperatura tiene un papel muy importante ya que a temperaturas superiores aproximadamente entre 300 y 320°C puede ocurrir la reacción de recombinación de H2S-olefina. Esta variable como ya se mencionó está íntimamente relacionada con el tipo de alimentación, ya que esta temperatura varía según la composición de esta, debido a que a temperaturas muy altas y con un catalizador muy activo puede causar craqueo cerca de la salida del reactor, produciendo olefinas.
La hidrodesulfuración de una nafta generalmente es la alimentación a una planta reformadora de naftas, que requiere la remoción de azufre a niveles de 0.5 ppm, para conseguir concentraciones de azufre de semejantes características, las correspondientes concentraciones de H2S y de olefinas deben de mantenerse relativamente bajos, para prevenir las reacciones de recombinación como se muestra en la reacción siguiente, la cual termodinámicamente es reversible. En la hidrodesulfuración las reacciones en conjunto se pueden considerar como combinaciones de la reacción y el paso desaturación para la obtención de parafinas como se muestra a continuación:
Reacción de reconversión de las olefinas.
Saturación de diolefinas
En la nafta proveniente de la planta de coquización retardada, la saturación de diolefinas antes del hidrotratamiento es esencial para la obtención de un producto de alta calidad, a diferencia de las olefinas que químicamente son compuestos semejantes, son saturadas por lo general en el reactor de hidrodesulfuración. Las diolefinas, por lo tanto debido a que a temperaturas normales de hidrotratamiento tienden a polimerizar o formar gomas ocasionando contaminación del catalizador y ensuciamiento del equipo.
Estas diolefinas principalmente provienen del corte de la destilación primaria o de las plantas FCC y especialmente de las plantas de coquízaclón retardada, estos son compuestos del tipo dieno como se muestra a continuación:
Se ha encontrado que las diolefinas y algunos compuestos aromáticos pueden ser removidos a temperatura relativamente baja considerando que otras reacciones ocurren a altas temperaturas, por lo tanto deben de ser removidas antes del hidrotratamiento con la finalidad de evitar los problemas ya mencionados. Esta temperatura que solo incluye a diolefinas y algunos compuestos aromáticos que pueden ser saturados por debajo de 203°C fue obtenida experimentalmente en planta piloto y fue considerando que otras reacciones no lo son; como olefinas, azufré y nitrógeno que comienzan a decrecer a 210°C.
En este sístemadereaccíón al tenerse que efectuar en forma separada de la reacción de hidrodesulfuración la temperatura y la presión son las variables de operación importantes para orientar la selectividad a la saturación de las diolefinas del tipo 1-3 butadieno y 1-3 pentadieno y diolefinas con 6 átomos de carbono.
Un punto a considerar ya mencionado es el nivel térmico requerido, esto es con la finalidad de alcanzar el mayor nivel de energía de activación de las especies catalíticas; minimizando las reacciones de hidrogenación de olefinas, desintegración de hidrocarburos ligeros y coquización debido a la concentración de insaturados y la exotermicidad de las reacciones típicas de la diolefinas, sin embargo, estas reacciones pueden presentar. La siguiente reacción es la que se observa:
Reacción de hidrogenación de las diolefinas
La nafta de alimentación que entra al sistema de reacción de saturación de diolefinas es recomendable mantenerlo en fase liquida con un mínimo de vaporización para favorecer la reacción de adición de hidrógeno y es recomendable mantener la presión en un rango entre 40-60 Kg/cm2 manométricas.
Algunas de las reacciones típicas de diolefinas se muestran a continuación:
Variables de control de proceso (Sección de Reacción)
El control y buen funcionamiento de una planta dependen básicamente de una elección adecuada de las condiciones de operación de los distintos equipos que integran el proceso, la eficiencia del proceso de desulfuración depende de las condiciones de operación empleadas para operar a condiciones óptimas y poder alcanzarse niveles de eliminación de azufre superiores al 99%.
Los hidrocarburos formados en las reacciones de desulfuración tienen puntos de ebullición menores a los compuestos de los cuales proceden. Tanto las condiciones de operación como el catalizador son seleccionados de tal manera que se minimicen las reacciones laterales como la deshidrogenación, desnitrogenación, entre otras.
Por ello, el grado de desulfuración de cualquier tipo de carga es función directa de los siguientes parámetros básicos para el control de proceso de la sección de reacción:
o Temperatura.
o Presión Parcial (del hidrógeno).
o Flujo.
o Relación hidrógeno/hidrocarburo (H2/HC).
o Espacio velocidad (Liquid Hourly Space Velocity ó LHSV).
o Catalizador.
Y a continuación procederemos a describir cada una de ellas:
Temperatura
La temperatura es una variable que afecta directamente el desarrollo de las distintas reacciones que se llevan a cabo en el equipo de reacción, (reactor), por ello en la actualidad las reacciones son llevadas a cabo en distintos reactores debido a la gran variación de temperaturas a las que se da lugar la reacción. Cabe mencionar, que aunque todas las reacciones que ocurren en el proceso de eliminación de azufre son exotérmicas, las reacciones de saturación de diolefinas, olefinas, y descomposición de compuestos de nitrógeno son las que liberan mayor cantidad de energía.
El efecto de un incremento de temperatura de reacción aumenta la velocidad de reacción, y por lo tanto, el nivel de desulfuración. A temperaturas inferiores a 280°C las velocidades de reacción tienden a disminuir y arriba de 410°C ocurren reacciones indeseables generando ligeros y excesivo depósito de carbón sobre el catalizador. En el diseño de unidades de hidrodesulfuración, la temperatura de inicio de corrida es fijada por el tipo de producto desulfurado, la presión y ciertos factores económicos. Como resulta obvio, las cargas ligeras son fácilmente desulfuradas a bajas temperaturas de operación, la cual se incrementa en función directa con el rango de ebullición de la carga (alimentación) a tratar.
Para el caso de la saturación de diolefinas las temperaturas de reacción deben de ser controladas ya que determina las velocidades de reacción de hidrogenación de estas. Un criterio que debe de ser tomado en cuenta para el diseño y operación de una planta de hidrodesulfuración que contenga en la corriente de alimentación diolefinas es la exotermicidad de la reacción. Esta temperatura no debe de exceder a 210°C por lo que es necesario mantener estable esta temperatura debido a que las diolefinas tienden a polimerizar a altas temperaturas provocando taponamiento o ensuciamiento en los equipos.
En cambio la temperatura de remoción de sílice a la entrada de alimentación del reactor se determina considerando que este sistema se ve favorecido en un medio totalmente vaporizado (100% vapor) por lo que aproximadamente la temperatura de reacción se encuentra entre 250 a 290°C.
Ambos casos (saturación de diolefinas y remoción de sílice) son casos particulares que actualmente se tratan de manera independiente en equipos separados, esto es con respecto a las reacciones de hidrodesulfuración.
La saturación de olefinas se comporta de manera semejante a la reacción de hidrodesulfuración con respecto a la temperatura, con la excepción de que el incremento de la velocidad de reacción se mantiene a mayores temperaturas; y aproximadamente a 427°C se obtienen aparentes condiciones de equilibrio en las cuales el grado de saturación se limita.
El grado y rapidez de la desulfurización se incrementa visiblemente cuando la temperatura aumentaa 343°C la velocidad de reacción es sumamente rápida manteniéndose este incremento hasta de 371°C por encima de la cual debe estabilizarse.
Como se puede observar en la siguiente figura dado un incremento de temperatura, los compuestos de azufre disminuyen. Involucrando todas las reacciones que ocurren en el reactor de hidrodesulfuración, la conversión deseada la temperatura se fija entre 326 y 475°C pero debe tomarse en cuenta que a temperaturas mayores a 400°C pueden llevarse a cabo las reacciones de hidrodesintegración. Aunque el Intervalo de la operación es amplio, la única limitación para alcanzar el valor máximo que comúnmente se fija en 370°C se debe a que el color del producto podría no cumplir con las especificaciones.
Presión Parcial del Hidrógeno
La importancia de la variación de presión, manteniendo las otras variables constantes provoca cambios en la conversión en las reacciones químicas, debido a que estas son favorecidas por la presión parcial que ejerce un exceso de hidrógeno. Variaciones normales en la presión o flujo de hidrógeno en el reactor no ocasionarán grandes cambios, pero si pudieran ocasionar diferencias apreciables en los productos.
Generalmente es posible obtener mayores rendimientos operando el reactor a presiones elevadas sin exceder el punto de rocío de la carga vaporizada.
Cuando la carga aumenta de peso molecular, se requiere de un aumento en la temperatura y por lo tanto resulta necesario también incrementar la presión de operación. Dependiendo de la temperatura de alimentación, la presión puede ser de 28 Kg/cm2 manométrica, para cargas ligeras y hasta 100 Kg/cm2 manométrica. Cuando la presión parcial del hidrógeno no se incrementa al aumentar la temperatura promedio de alimentación de la carga, se envenenará rápidamente el catalizador.
La elección de la presión de operación depende principalmente del tipo de carga (alimentación) y de la pureza de la corriente de hidrógeno. En términos prácticos, si el rango de ebullición de la carga se incrementa los compuestos de azufre se tornan más complejos y se requiere de presiones más altas para hacerlas reaccionar y prevenir la desactivación del catalizador por depósito de carbón.
Debido a que la presión parcial de hidrógeno es el factor decisivo y no la presión total del reactor, la pureza de la corriente de hidrógeno es determinante sobre la presión final elegida.
Flujo
Normalmente esta variable sólo involucra al flujo de entrada de hidrógeno, que se consume en el proceso por las reacciones de hidrodesulfuración así como tener el manejo del compresor dentro de los límites de su capacidad, ya que el flujo de circulación de hidrógeno y la pureza del mismo afectan directamente las velocidades de desulfuración, desnitrogenación, saturación de olefinas, y desoxigenación.
Relación Hidrógeno/hidrocarburo (H2/HC)
El consumo de hidrógeno dependerá del tipo de carga, del contenido de azufre que se tenga, de que se efectúe o no un número mayor de reacciones laterales y de las especificaciones deseadas para el producto; no obstante se observa que a medida que la carga se hace más pesada, aumenta el consumo de hidrógeno.
La figura anterior se muestra el consumo aproximado de hidrógeno de algunos compuestos típicos encontrados en las naftas.
Aunque las condiciones de operación y el valor de la relación H2/hidrocarburo son finalmente determinados por el tipo de catalizador, el tipo de carga y composición de la misma. Cuando se habla de naftas .ligeras, el valor de la relación H2/hidrocarburo es del orden de 450-550 SCF de H2 100%/barril de carga y las condiciones de operación del reactor son del orden de 352°C y 30 Kg/cm2 manométricas.
El consumo de hidrógeno, cuando la carga tiene un contenido de azufre de 800-900 ppm, se puede estimar en unos 70 SCF de H2 100%/barril de carga.
De igual forma, cuando se trata de destilados intermedios, el valor de la relación H2/hidrocarburo es del orden de 1500-2500 SCF de H2 100%/BBL de carga y las condiciones de operación del reactor son del-orden de 405°C Y 60 Kg/cm2 manométricas.
La relación H2/hidrocarburo es menos influyente que el espacio velocidad del reactor. A relaciones muy bajas, la presión de vapor de hidrógeno no es apropiada para las condiciones de conversión de los aromáticos y nafténicos. A relaciones muy altas, se disminuye el tiempo de contacto en el reactor.
Espacio Velocidad (Liquid Hourly Space Velocity o LHSV)
El término LHSV (Liquid Hourly Space Velocity), indica los pies cúbicos de carga por hora por cada pie cúbico de catalizador en el reactor y es un índice de la severidad de operación:
Mientras menor es el LHSV, mayor será la severidad y mientras menor sea el espacio velocidad, el grado de reacción se incrementará ya que el LHSV es inversamente proporcional al tiempo de contacto. El valor de LHSV varía de acuerdo a la carga procesada.
Después de la selección de la presión parcial de H2 y la temperatura de operación es posible usar correlaciones para seleccionar un óptimo valor de LHSV de acuerdo con los requerimientos de desulfurización deseada.
Catalizador
La composición y estructura de los catalizadores de hidrodesulfuración tienen primordial importancia en las reacciones de hidrogenación y desulfuración. Los catalizadores de níquel y platino que son muy activos para reacciones de hidrogenación, son fácilmente envenenados por compuestos de azufre, haciéndolos insatisfactorios para las reacciones combinadas de hidrodesulfuración, por lo que se requiere el empleo de un catalizador resistente al proceso dual hidrogenación - desulfuración. Con lo cual el catalizador utilizado para hidrodesulfuración tiene la obligación de cumplir con una doble función:
1. El craqueo de hidrocarburos de alto peso molecular.
2. La hidrogenación de compuestos insaturados formados durante el proceso de craqueo o presentes en la alimentación.
Los catalizadores de hidrodesulfuración son manufacturados con metales promotores en forma de óxidos constituidos básicamente de cuatro elementos:
o Metales activos: Es el elemento que imparte la actividad catalítica de mayor efecto en las reacciones de hidrogenólisis e hidrogenación. Teniéndose entre estos al molibdeno como uno de los más activos y de alta aplicación industrial.
o Promotores catalíticos: Es el elemento que proporciona e incrementa la selectividad de una reacción en especial. Teniéndose entre estos al níquel cobalto y sílice.
o Aditivos dé estabilidad: Este elemento proporciona la estabilidad tanto térmica como mecánica. Teniéndose como ejemplo: boro, titanio grafito (aditivos de estabilidad mecánica), lantano y cerio (aditivos de estabilidad térmica).
o Soporte: Este elemento proporciona el soporte de las especies activas como de los aditivos que integran el catalizador. Teniéndose entre de los de uso más común a lasaluminas activas y en especial la gamma alúmina.
Entre los catalizadores resistentes al azufre, los cuales han sido considerados aceptables para hidrogenación y desulfuracion combinadas son:
a) Co-Mo
b) Ni-Mo
c) Ni-Mo-W
En general el catalizador Co-Mo son utilizados en su mayoría para desulfurización y los catalizadores Ni-Mo presentan mayor afinidad para efectuar los procesos de desnitrogenación e hidrogenación.
Estudios realizados en planta piloto por Syed A. Ali, Jamal A. Anabtawi recomiendan el uso de una combinación de catalizador Ni-Mo en la parte superior 10 a 15 % del reactor y la parte restante utilizar como catalizador Co-Mo, para efectuar las reacciones de hidrogenación de olefinas y evitar posibles recombinaciones de reacción en la salida del reactor.
A continuación se muestra una figura conocida como el árbol de ayuda de decisión para elección de catalizador de hidrotratamiento. Que aunque la elección del tipo de catalizador depende del objetivo del proceso, en el cual las variables y condiciones de diseño y operación son de gran importancia.
Para el diseño del equipo de reacción, los siguientes criterios de diseño son específicos para el hidrotratamiento de nafta 100% de coquización, sin embargo, pueden ser tomados en cuenta para el diseño general de reactores de plantas de hidrodesulfuración de este tipo; debido a que contiene nafta proveniente de una Planta de Coquización Retardada.
Cabe destacar que el diseño de alguna planta en particular cambia, debido a que los equipos y criterios a utilizar están determinados de acuerdo al tipo de carga a procesar.
Reactor de Diolefinas
El diseño de este sistema de reacción debe considerar las condiciones necesarias para que el equipo opere en forma continua tomando como base los siguientes aspectos:
o Fase totalmente líquida.
o Saturación total de diolefinas con ligera saturación de olefinas.
o Control de temperatura por altaexotermicidad.
o Corrientes de enfriamiento (Quench) para un buen control térmico.
o Intervalo de temperatura entre 120 y 200°C.
o Temperatura mínima de saturación de diolefinas 125°C.
o Catalizador altamente selectivo de metales nobles recomendable usar para diolefinas =Ni o Pd, para olefinas = Ni-Mo.
o Presión de operación aprox. de 54 a 68 kg/cm2 manométricas.
o ΔT=15 a 30°C.
o Altos niveles de espacio velocidad, LHSV = 5 a 8.
o Relación H2/HC =150 a 250 ft3 / Barril.
Bibliografía
· Mejoramiento de la sección de reacción de la planta de hidrodesulfuración de naftas No. 2 Cadereyta N.L. Alejandro Osvaldo Monroy Hernández. FES Zaragoza. 2005 México.
· Estudio cinético de las reacciones de desintegración catalítica de gasóleos. Jorge Ancheyta Juárez. UAM Unidad Iztapalapa. 1998 México D.F.










